L’histoire du kuru, comme elle est décrite dans les manuels de biologie, est tragique. La population Fore en Papouasie-Nouvelle-Guinée mangeait le cerveau des membres de leur tribu comme rituel de deuil, ce qui a permis à une protéine difforme de se répandre dans la population. Cela a engendré la maladie de kuru, qui a tué plus de 10 % de la population dans le milieu du XXe siècle.
Un reportage sur la découverte de cette maladie :
Récemment, des scientifiques ont identifié des mutations chez certains des survivants qui les mettent à l’abri du Kuru et éventuellement d’autres maladies cérébrales similaires.
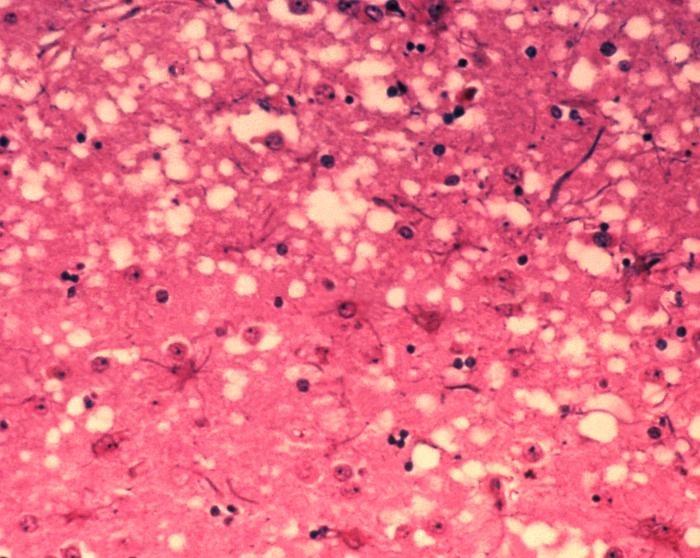
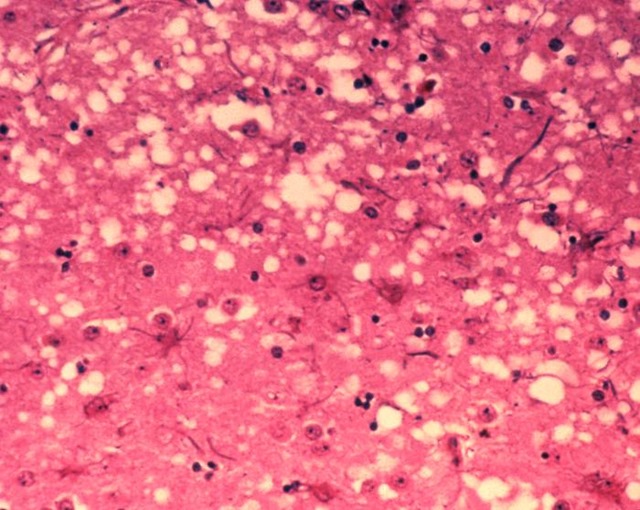
Le Kuru et la maladie de Creutzfeldt-Jakob (la forme humaine de la vache folle) sont causés par un type de protéines mal repliées appelées prions. Ces derniers se propagent en poussant les protéines normales à adopter leur difformité. Alors que les prions se propagent à travers le cerveau, ils engendrent des trous microscopiques, transformant le cerveau en "éponge" (spongieux). Plusieurs protéines différentes peuvent devenir prions, mais la première protéine découverte, à adopter cette forme, est appelée prion pathologique, ou PrP. La forme du prion PrP provoque à la fois le kuru et la maladie de Creutzfeldt-Jakob.
Image d’entête : coupe de tissu cérébral présentant les modifications de l’organisation cellulaire lors d’une encéphalopathie spongiforme bovine (maladie de la vache folle)
La pratique consistant à manger les cerveaux des morts a été interdite en Papouasie-Nouvelle-Guinée en 1950. En 2009, les chercheurs sont retournés pour effectuer une analyse génétique des femmes qui avaient survécu à l’épidémie de kuru. Ces dernières lors du rituel funéraire anthropophage mangeaient le système nerveux central alors que les hommes consommaient les muscles. Ils ont trouvé deux mutations dans la PrP, dans les 127e et 129e acides aminés de la protéine.
L’équipe a depuis confirmé leurs résultats avec une nouvelle étude chez la souris. Ils ont “créé” des souris avec ces deux mutations et ils ont testé leur comportement lorsqu’elles étaient exposées au kuru et à la maladie de Creutzfeldt-Jakob. Les souris avec une seule copie de la mutation du 129é présentaient une certaine résistance aux maladies à prions. Les souris avec une ou deux copies de la mutation en 127 étaient complètement résistantes.
Les chercheurs ne savent toujours pas pourquoi un changement d’acide aminé dans la PrP fait une aussi grande différence. Mais cela représente un exemple fascinant d’une immunité qui a évolué face à une maladie mortelle, ce qui pourrait conduire à de meilleurs traitements.
L’étude publiée dans Nature : A naturally occurring variant of the human prion protein completely prevents prion disease.

Un magnifique reportage. Je remercie des gens tel que le professeur Michael Alpers d’avoir consacré sa vie à faire avancer la médecine au travers de ses recherches. Ce reportage est magnifique et bouleversant.
Merci