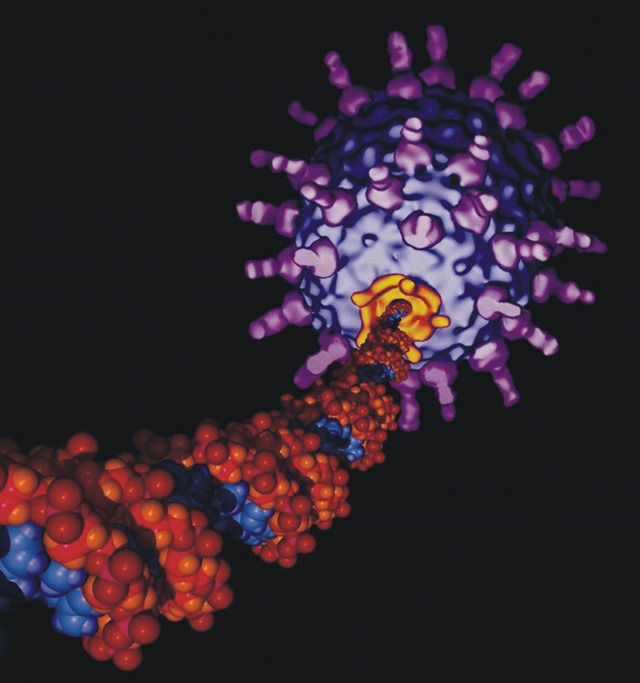
Deux nouvelles études montrent que des infections virales sont possibles en raison d’une remarquable transition de phase biologique. Les recherches montrent que l’ADN viral passe d’un solide vitreux à un état similaire à un liquide lorsque les conditions d’infection sont bonnes. Cette nouvelle découverte pourrait déboucher sur de nouvelles thérapies antivirales.
L’ADN, qui est bien empaqueté à l’intérieur de la coquille (capside) de protéines d’un virus, est plus dense que ce qui se trouve dans le noyau d’une cellule humaine. En raison de cet emballage étanche, la chaîne génétique peut à peine bouger, ce qui n’empêche pas la plupart des infections de se produire. Les virus injectent rapidement leur ADN dans la cellule hôte. Mais comment ? Comment l’ADN “durcis/ gelé” sous haute pression peut-il devenir soudainement assez liquide pour que cela se produise ?
Deux nouvelles études ont travaillé sur les mécanismes de ce processus. Alex Evilevitch de l’université américaine Carnegie-Mellon a montré que certains virus subissent une transition de phase à la température de l’infection, ce qui permet à l’ADN de se transformer à partir d’une structure cristalline rigide, semi-rigide en une forme de fluide qui facilite l’infection.
Ci-dessous : comment l’ADN du virus de l’herpès HSV-1 subit une transition solide-liquide au sein de la capside (Evilevitch et al)
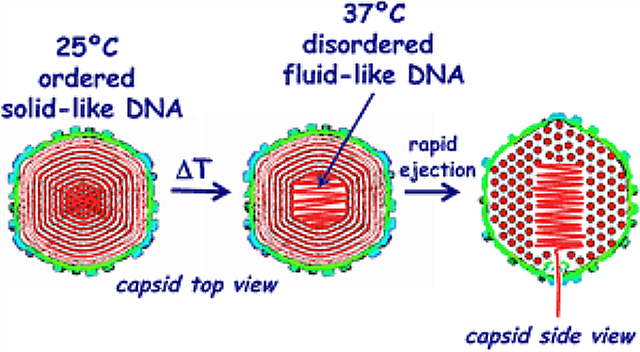
Selon Evilevitch :
La partie intéressante est que les propriétés physiques de l’ADN empaqueté jouent un rôle très important dans la propagation d’une infection virale, et ces propriétés sont universels. Cela pourrait conduire à une thérapie qui n’est pas liée à la séquence de gène du virus ou à la structure de la protéine, ce qui rendrait le développement d’une résistance à une thérapie hautement improbable.
Comment l’ADN viral applique sa ruse ?
Pour le bactériophage lambda, qui infecte des bactéries Escherichia coli dans l’intestin humain, les chercheurs ont étudié la compressibilité de l’ADN en utilisant la microscopie à force atomique et l’énergie libérée lors de l’injection en fonction de la température. Ils ont découvert que l’ADN, étroitement emballé, “fond” et devient suffisamment mobile pour être injecté lorsque la température s’approche de celle du corps humain, autour de 37 °C.
La preuve d’une transition structurelle est très frappante. L’effet sur l’éjection n’est pas strict, car les virus phage lambda infectent les bactéries cultivées dans une boîte de Petri à des températures plus basses. La température a aussi des effets complexes sur le métabolisme des cellules hôtes à partir desquelles les virus tirent leurs ressources. Cependant, les études actuelles révèlent un effet clair et intéressant de la température sur les propriétés physiques de l’ADN dense.
Dans une autre étude sur l’herpès simplex virus de type 1 (HSV-1), qui peut se trouver dans des cellules humaines pendant de longues périodes et qui injecte son ADN dans le noyau où il se réveille, le groupe d’Evilevitch (Carnegie Mellon) a constaté que les conditions ioniques dans le cytoplasme de la cellule hôte, ainsi que sa température, sont des facteurs clés qui déterminent le moment où l’ADN est liquéfié en vue de l’injection. L’ADN conserve son état solide tant que les conditions ne sont pas idéales pour l’infection, stabilisant ainsi la particule virale et s’assurant que son ADN n’est pas éjecté au mauvais moment. C’est ici où les thérapeutes devront s’attarder lors de l’élaboration de leurs traitements antiviraux.
L’étude publiée dans PNAS : Solid-to-fluid–like DNA transition in viruses facilitates infection et sur Nature Chemical Biology : Solid-to-fluide DNA transition inside HSV-1 capsid close to the temperature of infection.